









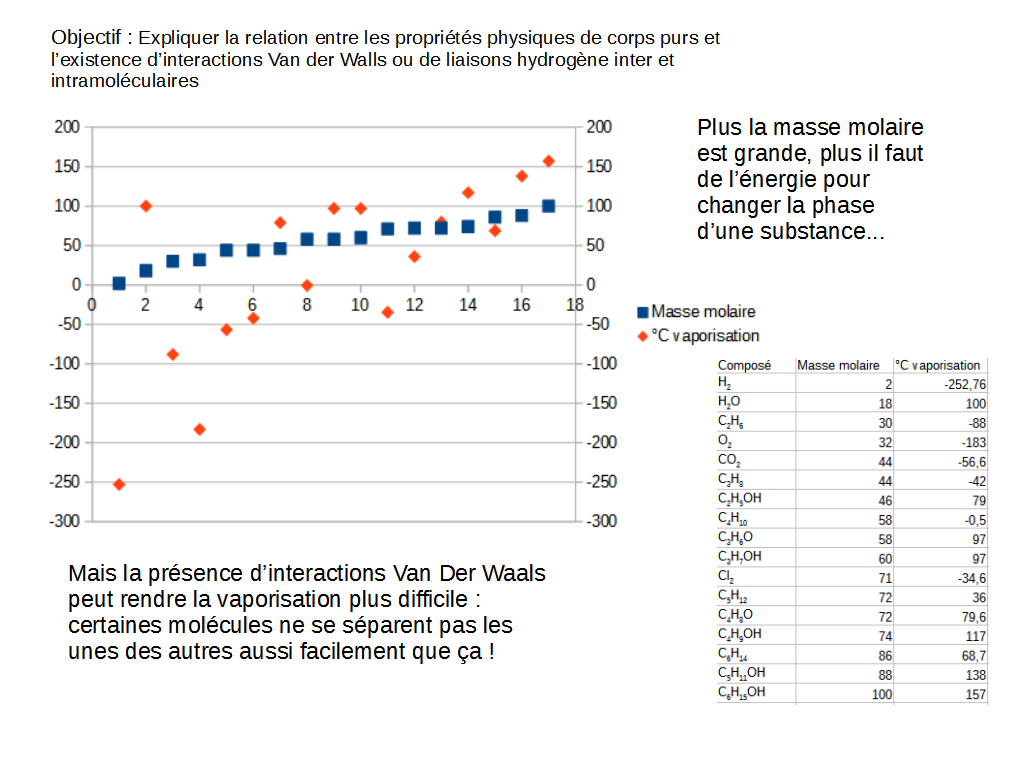
La première manifestation d’interactions Van der Waals, incluant la liaison hydrogène, se voit dans l’évolution du point d’ébullition de plusieurs substance.
Ainsi, comme on peut le deviner, il faut plus d’énergie pour bouger une grosse molécule qu’une petite. Quelques exceptions sont visibles, dont l’eau (H₂ O).
En effet, la liaison hydrogène qui existe entre deux ou trois molécules d’eau rendent son évaporation difficile : il faut encore plus d’énergie pour séparer les molécules. Ainsi, même si cette molécule est relativement légère, elle a un point d’ébullition élevé.
Question de synthèse
Comparer deux autres molécules et inférer si une interaction Van der Waals est en jeu.