









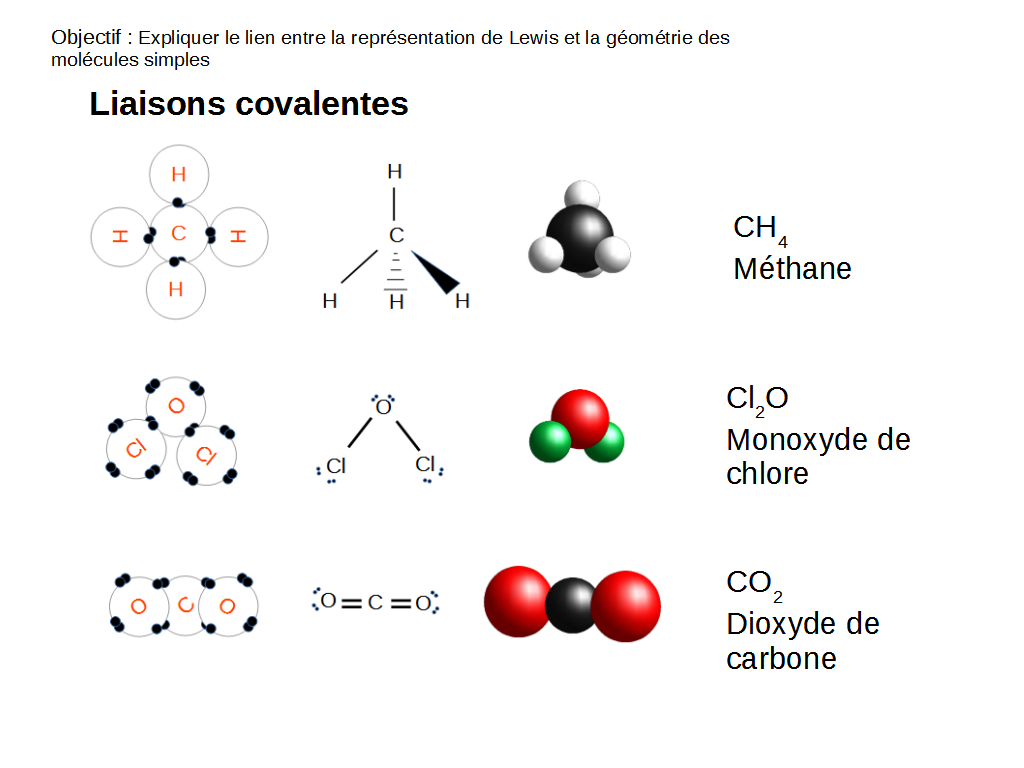
La forme d’une molécule dépend de la distribution des charges (paires d’électrons) autour des éléments qui la composent. En effet, qu’ils fassent partie d’une liaison chimique ou d’une orbitale pleine, les paires d’électrons se repoussent. La forme définitive d’une molécule est atteinte lorsque ces paires sont aussi éloignées les unes des autres que possible.
Les trois exemples ci-dessus sont les formules développées, topologiques, 3D et brutes de trois molécules.
On note que la formule topologique prend en compte l’écart entre les paires d’électrons. Une liaison hachurée va vers l’arrière, et une liaison pleine va vers l’avant.
La formule brute ordonne les éléments par ordre croissant d’électronégativité, sauf pour les hydrocarbures.
Question de synthèse
Lequel de ces exemples est un hydrocarbure ? En quoi la règle d’écriture des formules brutes change ?