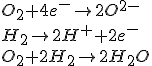Oxydoréduction
 Lors d'une réaction d'oxydoréduction, un élément ou composé chimique donne un ou plusieurs électrons à un autre élément ou composé chimique. Par exemple, si on met en présence des ions de cuivre avec des atomes d'aluminium, une réaction d'oxydoréduction se produit.
Lors d'une réaction d'oxydoréduction, un élément ou composé chimique donne un ou plusieurs électrons à un autre élément ou composé chimique. Par exemple, si on met en présence des ions de cuivre avec des atomes d'aluminium, une réaction d'oxydoréduction se produit.
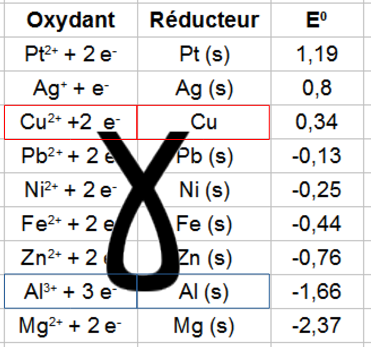
En effet, si on applique la règle du gamma à un tableau des couples oxydoréducteurs, on obtient les deux demi-équations suivantes :
![]()
Cu^{2+} + 2 e^- \rightarrow Cu (s)\\ Al(s) \rightarrow Al^{3+} + 3 e^-
On équilibre les équations en multipliant la première demi-équation par le nombre d'électrons dans la deuxième, et inversement.
![]()
3 Cu^{2+} + 6 e^- \rightarrow 3 Cu (s)\\ 2 Al(s) \rightarrow 2 Al^{3+} + 6 e^-
On supprime les électrons et on fait la somme des deux demi-équations:
![]()
3 Cu^{2+} + 2 Al (s) \rightarrow 3 Cu (s) + 2 Al^{3+}
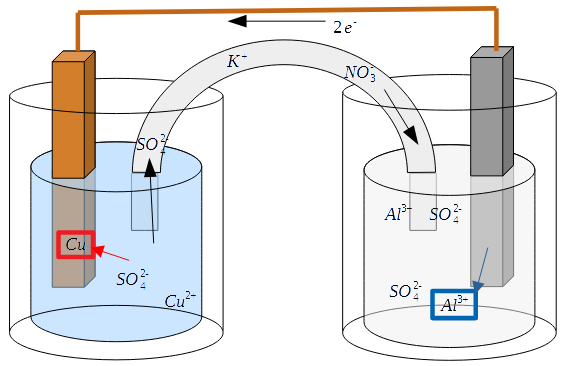 De cette équation, on peut conclure que si on place une électrode en cuivre dans une solution contenant des ions Cu2+, et qu'on la connecte à une électrode en aluminium plongée dans une solution contenant des ions Al3+, un transfert d'électrons se produit entre les deux électrodes.
De cette équation, on peut conclure que si on place une électrode en cuivre dans une solution contenant des ions Cu2+, et qu'on la connecte à une électrode en aluminium plongée dans une solution contenant des ions Al3+, un transfert d'électrons se produit entre les deux électrodes.
Un transfert d'électrons est un courant (ou intensité électrique i), et à tout courant est associée une tension U. Cette tension est la différence en potentiels oxydoréducteurs des deux couples E0 (voir tableau).
![]()
U = E^0_{oxydant}-E^0_{reducteur}
Dans le cas du cuivre et de l'aluminium, un rapide calcul donne une tension de 2 volts.
Théoriquement, on pourrait recharger une pile en appliquant une tension dans le sens inverse. Mais la formation de dendrites (voir illustration ci-dessous) sur l'anode ainsi que l'apparition de bulles d'hydrogène résultant de l'électrolyse de l'eau présente dans les solutions ne permet pas de recharger efficacement une pile.
Par NASA — NASA, uploaded from <a href="https://en.wikipedia.org/wiki/Image:Idge.gif" class="extiw" title="en:Image:Idge.gif">en:Image:Idge.gif</a>, originally uploaded by <a href="https://en.wikipedia.org/wiki/user:Vsmith" class="extiw" title="en:user:Vsmith">Wsmith</a>, 02:37, 5 March 2005, Domaine public, Lien
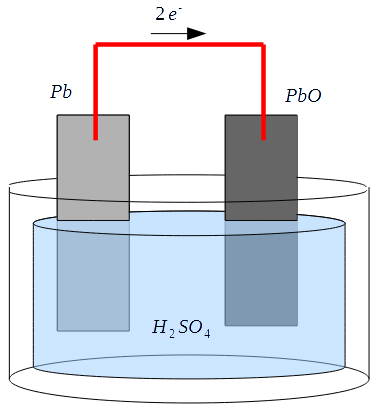 Il est possible d'utiliser des réactions d'oxydoréduction pour charger et recharger un système d'électrodes et de solution. Par exemple, une batterie au plomb telle qu'on en trouve dans les automobiles est une batterie composée d'une anode en plomb, d'une cathode en oxyde de plomb, les deux électrodes baignant dans une solution d'acide sulfurique. Le principe de fonctionnement ici est basé sur plusieurs réactions d'oxydoréduction se produisant en même temps.
Il est possible d'utiliser des réactions d'oxydoréduction pour charger et recharger un système d'électrodes et de solution. Par exemple, une batterie au plomb telle qu'on en trouve dans les automobiles est une batterie composée d'une anode en plomb, d'une cathode en oxyde de plomb, les deux électrodes baignant dans une solution d'acide sulfurique. Le principe de fonctionnement ici est basé sur plusieurs réactions d'oxydoréduction se produisant en même temps.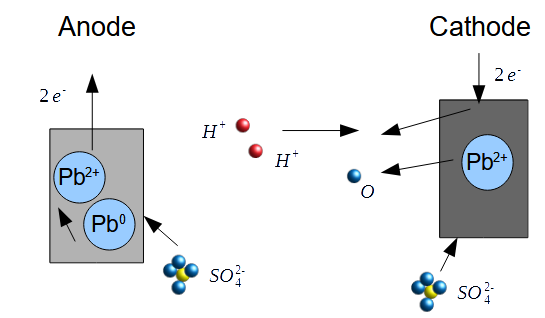 A la cathode, les électrons sont récupérés par les ions d'hydrogène oxydés à l'anode, et ils se combinent avec l'oxygène de la cathode en oxyde de plomb pour former de l'eau.
A la cathode, les électrons sont récupérés par les ions d'hydrogène oxydés à l'anode, et ils se combinent avec l'oxygène de la cathode en oxyde de plomb pour former de l'eau.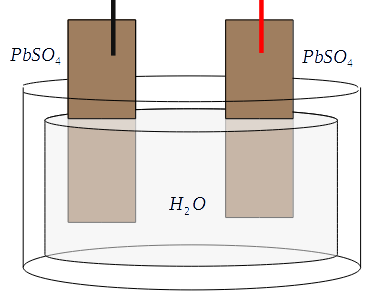 Lorsque l'accumulateur est déchargé, il ne reste plus que de l'eau et deux électrodes en sulfate de plomb.
Lorsque l'accumulateur est déchargé, il ne reste plus que de l'eau et deux électrodes en sulfate de plomb. Une pile à combustible est, comme son nom ne l'indique pas, un accumulateur qui utilise l'électrolyse de l'eau pour stocker et restituer de l'énergie électrique.
Une pile à combustible est, comme son nom ne l'indique pas, un accumulateur qui utilise l'électrolyse de l'eau pour stocker et restituer de l'énergie électrique.