Chaleur et réaction en chaîne
La combustion est un type d'oxydoréduction. Dans ce cas, c'est en effet le dioxygène qui sert d'oxydant. On parle alors de comburant, une substance qui permet l'oxydation d'un combustible.
Une réaction de combustion est assez simple : prendre un combustible, comme par exemple le méthane; y ajouter du dioxygène ; on obtient alors du dioxyde de carbone et de l'eau.
![]()
CH_4 + 2 O_2 \rightarrow CO_2 + 2 H_2 O
Sachant ce que l'on sait sur l'électronégativité et l'oxydoréduction, on peut ajouter quelques détails à ce qui se passe lors d'une réaction de combustion.
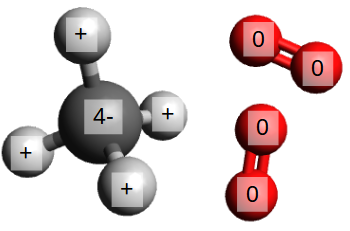 Voyons tout d'abord les réactants : le CH4 est un hydrocarbure, une molécule qui contient de l'hydrogène ("hydro-") et du carbone ("-carbure"), et le dioxygène, une molécule qui est le déchet du procédé de photosynthèse lors de la croissance des plantes et cyanobactéries.
Voyons tout d'abord les réactants : le CH4 est un hydrocarbure, une molécule qui contient de l'hydrogène ("hydro-") et du carbone ("-carbure"), et le dioxygène, une molécule qui est le déchet du procédé de photosynthèse lors de la croissance des plantes et cyanobactéries.
Dans une molécule de CH4, l'élément le plus électronégatif est le carbone. Même si carbone et hydrogène sont tous les deux des non-métaux, la différence d'électronégativité est telle que les électrons dans chaque liaison covalente sont plus proches du carbone que de l'hydrogène. On dit alors que l'atome de carbone a une charge de 4- (un électron par hydrogène), et que chaque hydrogène a une charge de 1+.
Si on donne au CH4 un peu d'énergie (sous forme de chaleur, comme une étincelle), les liaisons covalentes vont se défaire. Comme le carbone est plus électronégatif que l'hydrogène, il est possible qu'il emporte avec lui un ou plusieurs électrons, laissant derrière lui un ou plusieurs atomes d'hydrogène ionisés (avec des électrons en moins). On appelle ces atomes avec une charge partielle des radicaux, et on les symbolise par la lettre de l'élément avec un point.
Le dioxygène est une molécule peu stable. Le moindre indice d'un élément un peu moins électronégatif (et, vu l'électronégativité de l'oxygène, ils le sont tous), et le dioxygène se sépare. Ayant par définition la même électronégativité, les atomes d'oxygène ont une charge égale à zéro, et ils n'ont pas besoin de beaucoup d'énergie pour se séparer.
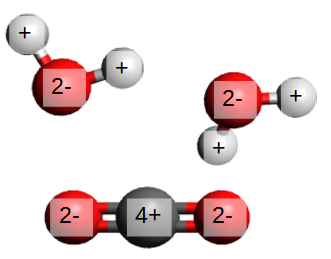 Une fois les atomes des réactants séparés, ils se recombinent. L'ordre dans lequel les recombinaisons se font dépend des électronégativités. La règle générale est simple : le plus électronégatif est attiré par le moins électronégatif. Ainsi, l'oxygène s'acoquine avec deux hydrogènes pour former une molécule d'eau (H2O). Pour l'hydrogène, qui avec le carbone avait une charge de 1+, rien ne change : l'oxygène s'accapare à son tour les électrons dans la liaison covalente. L'oxygène, lui, a gagné deux électrons, et a maintenant une charge de 2-. Il a été réduit.
Une fois les atomes des réactants séparés, ils se recombinent. L'ordre dans lequel les recombinaisons se font dépend des électronégativités. La règle générale est simple : le plus électronégatif est attiré par le moins électronégatif. Ainsi, l'oxygène s'acoquine avec deux hydrogènes pour former une molécule d'eau (H2O). Pour l'hydrogène, qui avec le carbone avait une charge de 1+, rien ne change : l'oxygène s'accapare à son tour les électrons dans la liaison covalente. L'oxygène, lui, a gagné deux électrons, et a maintenant une charge de 2-. Il a été réduit.
Maintenant ne reste que l'atome de carbone. S'il y a suffisamment de carbone et d'oxygène, des molécules de CO2 se forment. Le carbone, moins électronégatif que l'oxygène, "perd" ses charges et se retrouve avec une charge positive de 4+. Il a été oxydé. L'oxygène, lui, a gagné deux électrons : il a été réduit.
Donc, dans une réaction de combustion d'un hydrocarbure, l'oxygène est l'oxydant, le carbone le réducteur, et l'hydrogène... le pauvre gars qui se fait trimballer à droite et à gauche sans pouvoir garder son électron...
On a vu qu'il fallait un peu d'énergie pour commencer la réaction - pour casser les liaisons covalente du CH4 et du O2. Lorsque des molécules se reforment, c'est l'inverse qui se produit : de l'énergie est dégagée. Si l'énergie requise pour casser les liaisons covalentes est supérieure à l'énergie produite par la formation des produits, de la chaleur est absorbée. On dit de la réaction qu'elle est endothermique. Si l'énergie requise pour casser les liaisons covalentes est inférieure à l'énergie produite par la formation des produits, de la chaleur est émise. On dit de la réaction qu'elle est exothermique.
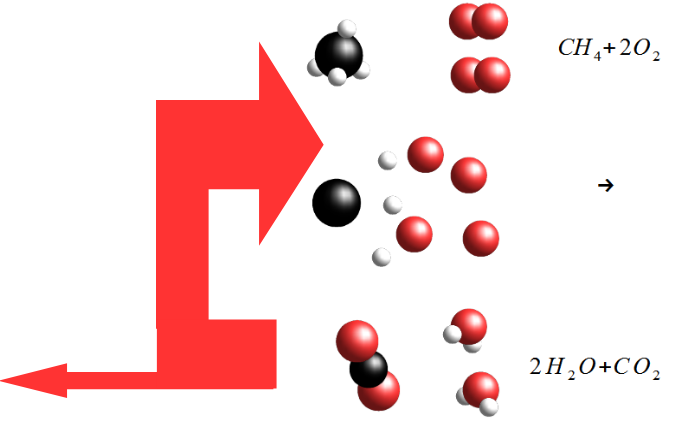 Comme vous le devinez, la combustion d'un hydrocarbure est très exothermique. Il se dégage suffisamment d'énergie pour briser les liaisons des autres molécules de CH4 et de O2, et ainsi continuer la formation de molécules de CO2 et de H2O. Celles-ci dégagent de l'énergie supplémentaire, et ainsi de suite. C'est ce qu'on appelle une réaction en chaîne. Cette réaction ne s'arrête que quand il n'y a plus de comburant (le dioxygène) ou de carburant (l'hydrocarbure), ou qu'on a trouvé moyen de retirer toute la chaleur de la réaction en chaîne pour la stopper. En ajoutant, par exemple, de l'eau.
Comme vous le devinez, la combustion d'un hydrocarbure est très exothermique. Il se dégage suffisamment d'énergie pour briser les liaisons des autres molécules de CH4 et de O2, et ainsi continuer la formation de molécules de CO2 et de H2O. Celles-ci dégagent de l'énergie supplémentaire, et ainsi de suite. C'est ce qu'on appelle une réaction en chaîne. Cette réaction ne s'arrête que quand il n'y a plus de comburant (le dioxygène) ou de carburant (l'hydrocarbure), ou qu'on a trouvé moyen de retirer toute la chaleur de la réaction en chaîne pour la stopper. En ajoutant, par exemple, de l'eau.