Un atome est plus une idée philosophique qu'une découverte scientifique - c'est simplement l'expression d'un fait logique : si on découpe quelque chose en des parties de plus en plus petites, on doit forcément se retrouver à un moment donné avec quelque chose d'indivisible. Si on se retrouvait avec rien, cela signifierait que tout est fait de rien, ce qui est dépourvu de sens.
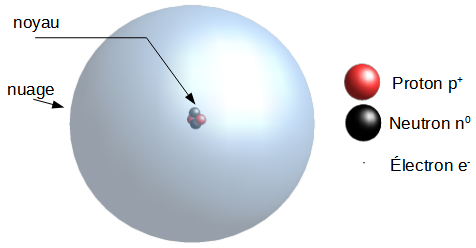 Il se trouve que ce qu'on appelle atome de nos jours n'est pas indivisible. Un atome est composé d'un noyau et d'un nuage d'électrons, le noyau lui-même est composé de protons et de neutrons, qui sont eux même composés de quarks... Si on peut encore parler d'atome comme élément constitutif de la matière, les choses sont un peu plus compliquées.
Il se trouve que ce qu'on appelle atome de nos jours n'est pas indivisible. Un atome est composé d'un noyau et d'un nuage d'électrons, le noyau lui-même est composé de protons et de neutrons, qui sont eux même composés de quarks... Si on peut encore parler d'atome comme élément constitutif de la matière, les choses sont un peu plus compliquées.
Pour s'y retrouver, on distingue différents types d'atomes. On parle alors d'éléments. Les éléments diffèrent les uns des autres par leur nombre de protons ou numéro atomique : un atome d'hydrogène n'a qu'un proton, un d'oxygène a 8 protons, un atome d'uranium en à 92.
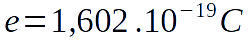 Sachant qu'un proton a une charge électrique égale à +e, et qu'un électron a une charge de -e, il y a nécessairement autant d'électrons que de protons dans un atome neutre. Les électrons étant organisés en couches électroniques, elles-mêmes divisées en orbitales, chaque élément a une configuration électronique qui lui est particulière.
Sachant qu'un proton a une charge électrique égale à +e, et qu'un électron a une charge de -e, il y a nécessairement autant d'électrons que de protons dans un atome neutre. Les électrons étant organisés en couches électroniques, elles-mêmes divisées en orbitales, chaque élément a une configuration électronique qui lui est particulière.
 Pour y voir un peu plus clair, on organise tous les éléments dans un tableau périodique. Chaque ligne ou période correspond a une couche électronique, chaque colonne ou groupe correspond à peu près a une configuration de la couche de valence. La couche de valence est le nom donné à la couche électronique externe d'un élément, dans laquelle des paires d'électrons ou des électrons célibataires se trouvent. C'est la configuration électronique de la couche de valence qui détermine les propriétés chimiques d'un élément.
Pour y voir un peu plus clair, on organise tous les éléments dans un tableau périodique. Chaque ligne ou période correspond a une couche électronique, chaque colonne ou groupe correspond à peu près a une configuration de la couche de valence. La couche de valence est le nom donné à la couche électronique externe d'un élément, dans laquelle des paires d'électrons ou des électrons célibataires se trouvent. C'est la configuration électronique de la couche de valence qui détermine les propriétés chimiques d'un élément.
Dans le tableau périodique, on distingue quatre groupes d'éléments:
- les métaux
- les non-métaux
- les métalloïdes ou semi-métaux
- les éléments nobles
 Les éléments nobles sont ainsi nommés parce qu'ils ne réagissent pas entre eux ou avec d'autres éléments. Les métaux sont peu électronégatifs (voir illustration ci-contre) - leurs électrons de valence sont peu attirés à eux. Les non-métaux sont très électronégatifs - leurs électrons de valence sont très attirés à eux. Les métalloïdes se comportent parfois comme un métal, parfois comme un non-métal.
Les éléments nobles sont ainsi nommés parce qu'ils ne réagissent pas entre eux ou avec d'autres éléments. Les métaux sont peu électronégatifs (voir illustration ci-contre) - leurs électrons de valence sont peu attirés à eux. Les non-métaux sont très électronégatifs - leurs électrons de valence sont très attirés à eux. Les métalloïdes se comportent parfois comme un métal, parfois comme un non-métal.
On notera aussi les éléments de groupe 1 et 2 (alcalins et alcalins terreux), de 3 à 12 (métaux de transition), 17 (halogènes).
On notera enfin que tous les éléments dans un groupe ont le plus souvent le même nombre d'électrons de valence. Ils ont aussi des propriétés similaires. Par corrélation, on devine que le nombre et la distribution des électrons autour d'un élément détermine ses propriétés chimiques.
 Il se trouve que ce qu'on appelle atome de nos jours n'est pas indivisible. Un atome est composé d'un noyau et d'un nuage d'électrons, le noyau lui-même est composé de protons et de neutrons, qui sont eux même composés de quarks... Si on peut encore parler d'atome comme élément constitutif de la matière, les choses sont un peu plus compliquées.
Il se trouve que ce qu'on appelle atome de nos jours n'est pas indivisible. Un atome est composé d'un noyau et d'un nuage d'électrons, le noyau lui-même est composé de protons et de neutrons, qui sont eux même composés de quarks... Si on peut encore parler d'atome comme élément constitutif de la matière, les choses sont un peu plus compliquées.