Composés chimiques
 Pour bien comprendre le phénomène d'oxydoréduction, on doit se rappeler de la cause de l'interaction entre élément: les différences d'électronégativité. Comme on l'a dit, l'électronégativité est la tendance qu'a un élément à attirer des électrons à lui-même. Un métal, peu électronégatif, ne "tire" pas sur ses propres électrons avec beaucoup de force. Un non-métal, très électronégatif, tire avec beaucoup plus de force. En conséquence, lorsqu'un métal rencontre un non-métal, ce dernier peut "prendre" un ou plusieurs électrons au métal. Il se forme alors un composé ionique.
Pour bien comprendre le phénomène d'oxydoréduction, on doit se rappeler de la cause de l'interaction entre élément: les différences d'électronégativité. Comme on l'a dit, l'électronégativité est la tendance qu'a un élément à attirer des électrons à lui-même. Un métal, peu électronégatif, ne "tire" pas sur ses propres électrons avec beaucoup de force. Un non-métal, très électronégatif, tire avec beaucoup plus de force. En conséquence, lorsqu'un métal rencontre un non-métal, ce dernier peut "prendre" un ou plusieurs électrons au métal. Il se forme alors un composé ionique.
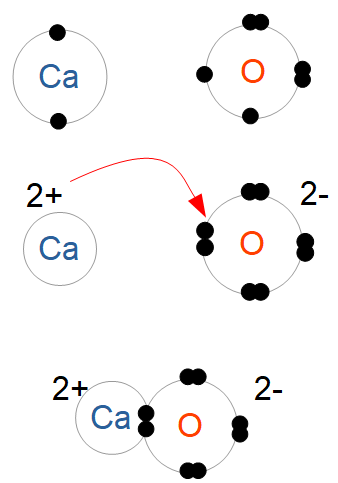
Par exemple, un atome de calcium donne ses deux électrons de valence à un atome d'oxygène. Il en résulte de l'oxyde de calcium. Les éléments échangent ainsi des électrons jusqu'à ce que tous les éléments dans le composé aient une couche externe pleine. Ici, le calcium n'a plus d'électrons sur sa couche de valence : sa couche externe est maintenant sa couche inférieure, pleine. L'oxygène a quant à lui complété sa couche de valence, qui ne peut contenir plus de 8 électrons.
On notera que lors de l'échange, les charges de chaque élément ont changé : le calcium a perdu deux électrons, et est devenu un ion positif (cation), tandis que l'oxygène a gagné deux électrons et est devenu un ion négatif (anion). En l'absence d'eau, cations et anions sont attirés l'un à l'autre et forment des cristaux ioniques.
Bien sûr, la distinction entre métaux et non-métaux est arbitraire. Les non-métaux aussi peuvent former des composés chimiques mais dans ce cas, on parlera plutôt de partage d'électrons et de liaisons covalentes. Les composés contenant uniquement des non-métaux sont communément appelés molécules.
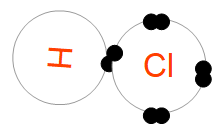 Par exemple, l'hydrogène et le chlore sont tous les deux des non-métaux. L'hydrogène a un électron célibataire sur sa couche de valence, et le chlore a aussi, en plus de trois paires, un électron célibataire. En partageant ces deux électrons célibataires hydrogène et chlore peuvent former une liaison covalente et, pour ces deux éléments, tout se passe comme s'ils avaient des couches de valence complètes (2 électrons pour l'hydrogène, 8 pour le chlore).
Par exemple, l'hydrogène et le chlore sont tous les deux des non-métaux. L'hydrogène a un électron célibataire sur sa couche de valence, et le chlore a aussi, en plus de trois paires, un électron célibataire. En partageant ces deux électrons célibataires hydrogène et chlore peuvent former une liaison covalente et, pour ces deux éléments, tout se passe comme s'ils avaient des couches de valence complètes (2 électrons pour l'hydrogène, 8 pour le chlore).
A première vue, il ne semble pas y avoir beaucoup de différence entre un composé ionique et une molécule. Après tout, ce ne sont juste que deux éléments accolés l'un à l'autre. La différence se voit dans la différence d'électronégativité. Entre un métal et un non-métal, cette différence est forte. Les deux éléments font une liaison très forte, difficile à briser - à moins de les mettre dans l'eau où la polarité du H2O les sépare. Dans ce cas, le métal devient un cation en solution, et le non-métal un anion.
Entre deux non-métaux, cette différence est faible, et la liaison entre les deux éléments peut être facilement cassée. L'élément le plus électronégatif conserve les deux électrons de la liaison chimique - on dit qu'il a été réduit. L'élément le moins électronégatif perd donc un électron - on dit qu'il a été oxydé.
L'oxydoréduction est donc ce phénomène pendant lequel certains éléments sont oxydés, et d'autres sont réduits.
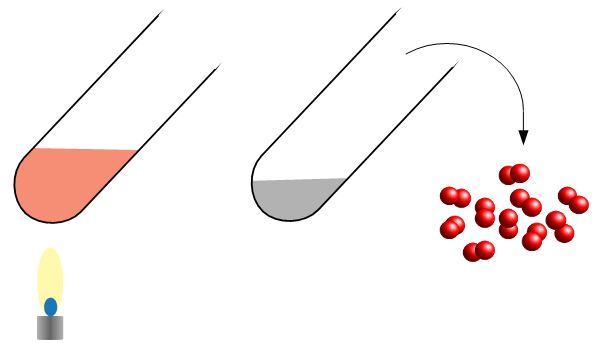 La raison de cette confusion vient de l'expérience qui a permis de découvrir l'oxygène, les éléments, et de lancer la discipline entière de la chimie (rien de moins) : la décomposition de l'oxyde de mercure par
La raison de cette confusion vient de l'expérience qui a permis de découvrir l'oxygène, les éléments, et de lancer la discipline entière de la chimie (rien de moins) : la décomposition de l'oxyde de mercure par 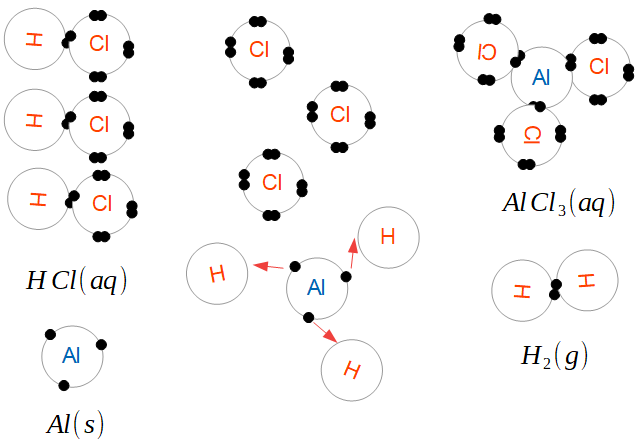 On verse de l'acide chlorhydrique HCl en solution (aq) sur le l'aluminium solide (s). En solution, le cation hydrogène et l'anion chlore sont séparés. Le chlore n'a plus de place pour un électron de plus, mais l'hydrogène n'en a carrément plus. En présence d'un élément faiblement électronégatif comme l'aluminium, l'hydrogène récupère un électron - comme l'aluminium a trois électrons de valence, il faut trois atomes d'hydrogène pour complètement oxyder un atome d'aluminium. L'aluminium devient alors fortement positif et s'associe aux anions de chlore : du chlorure d'aluminium AlCl3 en solution (aq). L'hydrogène, laissé seul avec lui-même, forme des liaisons covalentes : des molécules de dihydrogène H2, un gaz (g) à température et pression ambiantes.
On verse de l'acide chlorhydrique HCl en solution (aq) sur le l'aluminium solide (s). En solution, le cation hydrogène et l'anion chlore sont séparés. Le chlore n'a plus de place pour un électron de plus, mais l'hydrogène n'en a carrément plus. En présence d'un élément faiblement électronégatif comme l'aluminium, l'hydrogène récupère un électron - comme l'aluminium a trois électrons de valence, il faut trois atomes d'hydrogène pour complètement oxyder un atome d'aluminium. L'aluminium devient alors fortement positif et s'associe aux anions de chlore : du chlorure d'aluminium AlCl3 en solution (aq). L'hydrogène, laissé seul avec lui-même, forme des liaisons covalentes : des molécules de dihydrogène H2, un gaz (g) à température et pression ambiantes. Par exemple, si on met du cuivre dans une solution de sulfate d'argent, on observe un phénomène : peu à peu, le cuivre se dissout, et de petits cristaux d'argent apparaissent. La solution prend la couleur caractéristique d'une solution contenant des ions de cuivre.
Par exemple, si on met du cuivre dans une solution de sulfate d'argent, on observe un phénomène : peu à peu, le cuivre se dissout, et de petits cristaux d'argent apparaissent. La solution prend la couleur caractéristique d'une solution contenant des ions de cuivre.