Potentiel
On aura noté sur le tableau des couples oxydoréducteurs une troisième colonne contenant des chiffres. L'en-tête de cette colonne indique que ces valeurs sont des volts - l'unité de potentiel électrique. Dans le tableau, les valeurs les plus positives se trouvent vers le haut, les valeurs les plus négatives se trouvent vers le bas. On dit que plus la différence en potentiel entre deux couples oxydoréducteurs est grande, plus la réaction entre eux est rapide.
Vérifions cela avec trois réactions que nous connaissons déjà : la réaction entre l'acide d'une part, et le magnésium, l'aluminium et le cuivre d'autre part. On sait d'expérience qu'une réaction se produit avec les deux premiers métaux mais pas avec le troisième. Voyons ce que la théorie peut en dire.
Une première chose à se rappeler est qu'un acide donne des cations d'hydrogène. On va donc chercher dans le tableau le couple qui contient ces cations. On trouve le couple 2 H+ + 2 e- / H2. On fait de même avec les trois métaux et on suit la procédure décrite dans la page précédente.
|
Demi-équation 1 : 2 H+ + 2 e- / H2 Demi- équation 2 : Mg (s) / Mg2+ + 2 e- |
Demi-équation 1 : 2 H+ + 2 e- / H2 Demi- équation 2 : Al (s) / Al3+ + 3 e- |
Demi-équation 1 : 2 H+ + 2 e- / H2 Demi- équation 2 : Cu (s) / Cu2+ + 2 e- |
|
| Différence de potentiel ΔE = Eoxy - Ered |
0 - (-2.37) = 2.37 V |
0 - (-1.66) = 1.66 V |
0 - 0.34 = -0.34 V |
|
Potentiel très positif → réaction spontanée et rapide |
Potentiel positif → réaction spontanée |
Potentiel négatif→ réaction impossible |
|
| Equilibrer si besoin : |
2 H+ + 2 e- / H2 Mg (s) / Mg2+ + 2 e- |
6 H+ + 6 e- /3 H2 2 Al (s) / 2 Al3+ + 6 e- |
Pas de réaction |
| Réaction | 2 H+ + 2 e-+ Mg (s) → Mg2+ + 2 e- + H2 | 6 H+ + 6 e-+ 2 Al (s) → 2 Al3+ + 6 e- + 3 H2 | |
| Final | 2 H+ + Mg (s) → Mg2+ + H2 | 6 H+ + 2 Al (s) → 2 Al3+ + 3 H2 | |
| Avec l'acide complet : | 2 HCl + Mg (s) → Mg2+ + H2 | 6 HCl + 2 Al (s) → 2 Al3+ + 3 H2 |
On peut confirmer avec l'expérience : plus la différence en potentiel entre les couples oxydoréducteurs est grande et positive, plus la réaction est spontanée et rapide.
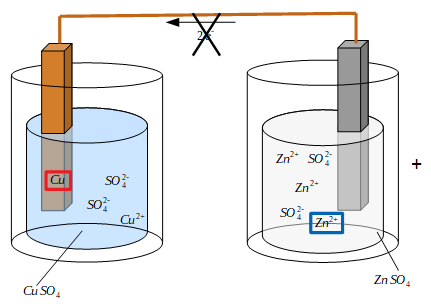 Tout d'abord, voyons d'où viennent ces valeurs dans le tableau en créant une pile de Daniell.
Tout d'abord, voyons d'où viennent ces valeurs dans le tableau en créant une pile de Daniell.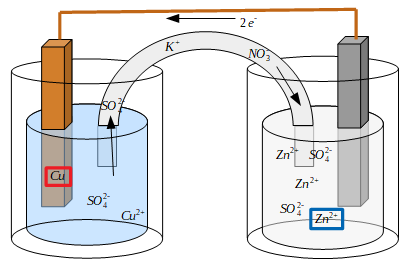 Le problème résidant dans les solutions qui deviennent négatives ou positives, la solution est de les connecter. Ainsi, tandis que le fil permet d'échanger des électrons, un pont salin (ou pont électrolytique) permet d'échanger des ions. En général, une pile de Daniell utilise une solution de nitrate de potassium K NO3.
Le problème résidant dans les solutions qui deviennent négatives ou positives, la solution est de les connecter. Ainsi, tandis que le fil permet d'échanger des électrons, un pont salin (ou pont électrolytique) permet d'échanger des ions. En général, une pile de Daniell utilise une solution de nitrate de potassium K NO3.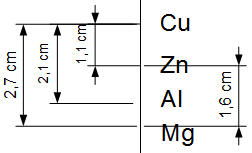 Si les électrodes sont en cuivre et zinc respectivement, ΔE est égal à 1,1 V. Si on échange la cathode en zinc pour du magnésium, la tension atteint 2.7 V. L'illustration ci-contre donne d'autres exemples (échelle 1 cm = 1 V).
Si les électrodes sont en cuivre et zinc respectivement, ΔE est égal à 1,1 V. Si on échange la cathode en zinc pour du magnésium, la tension atteint 2.7 V. L'illustration ci-contre donne d'autres exemples (échelle 1 cm = 1 V).