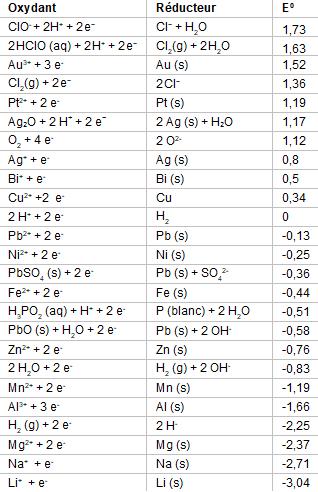
Tableau des couples oxydoréducteurs
Nous avons fait deux expériences pour découvrir le phénomène d'oxydoréduction sur des métaux. Nous avons aussi vu que certains métaux sont plus oxydables que d'autres. Nous pouvons donc répéter l'expérience pour voir si on pourrait créer un tableau de valeurs des métaux, du plus au moins oxydable.
 Tout d'abord, nous répétons l'expérience de l'acide chlorhydrique en solution (aq). Avec du magnésium, la réaction ressemble à la dissolution d'un cachet d'aspirine. Cette réaction est donc très rapide, et une solution de MgCl2 est tout ce qui reste après quelques minutes. On en déduit un couple oxydoréducteur Mg2+/ Mg. Dans ce couple, le premier terme est l'élément qui pourrait oxyder (prendre des électrons), et le deuxième terme est l'élément qui peut réduire (donner des électrons).
Tout d'abord, nous répétons l'expérience de l'acide chlorhydrique en solution (aq). Avec du magnésium, la réaction ressemble à la dissolution d'un cachet d'aspirine. Cette réaction est donc très rapide, et une solution de MgCl2 est tout ce qui reste après quelques minutes. On en déduit un couple oxydoréducteur Mg2+/ Mg. Dans ce couple, le premier terme est l'élément qui pourrait oxyder (prendre des électrons), et le deuxième terme est l'élément qui peut réduire (donner des électrons).
Avec de l'aluminium, comme on a déjà vu, une réaction se produit aussi. Elle est simplement un peu moins rapide qu'avec du magnésium, et le soluté restant est du chlorure d'aluminium AlCl3. On note le couple oxydoréducteur Al3+ / Al.
Avec du zinc, la réaction se produit encore mais elle mets encore plus de temps. Le soluté restant est du chlorure de zinc ZnCl2. On note le couple oxydoréducteur Zn2+ / Zn.
Avec du fer, la réaction est encore plus lente, mais on peut tout de même en déduire le couple Fe3+ / Fe. C'est avec le cuivre que tout s'arrête. Il semble que le cuivre est imperturbable face à la présence des cations d'hydrogène de l'acide chlorhydrique.
 Heureusement, on a une autre expérience dans notre besace : les ions métalliques en solution. Cela nous permettra de confirmer les rapports entre les différents couples (lequel est le plus fort) en même temps que de compléter notre liste.
Heureusement, on a une autre expérience dans notre besace : les ions métalliques en solution. Cela nous permettra de confirmer les rapports entre les différents couples (lequel est le plus fort) en même temps que de compléter notre liste.
Nous avons déjà vu que l'argent oxyde le cuivre. Nous avons donc un premier couple Ag+ / Ag.
En plaçant un morceau de zinc solide dans notre solution de cuivre, on déduit à nouveau le couple Zn2+ / Zn, et on infère le couple Cu2+ / Cu.
On confirme de la même manière les deux autres couples: Al3+ / Al et Mg2+/ Mg.
Forts de ces expériences, on peut créer un tableau rudimentaire des couples oxydoréducteurs, classés du plus oxydant au plus réducteur. On n'oubliera pas de la compléter avec un dernier couple qu'on a utilisé sans le mentionner depuis le départ: le couple H+ / H.
| ← plus oxydant | plus réducteur → | |||||
| Ag+ / Ag | Cu2+ / Cu | H+ / H | Fe3+ / Fe | Zn2+ / Zn | Al3+ / Al | Mg2+/ Mg |
Déjà, on peut prédire avec ce tableau qu'un acide n'aura aucun effet sur l'argent. En effet, l'argent est plus oxydant que les ions d'hydrogène donc, en toute logique, les ions d'hydrogène ne peuvent pas oxyder l'argent.
On peut aussi deviner que la réaction la plus rapide pourrait avoir lieu entre les ions d'argent et le magnésium : ils sont en effet chacun à un bout du tableau. Nous pourrions donc répéter l'expérience avec une grande quantité de métaux et de composés chimiques pour obtenir un tableau similaire nous permettant de prédire des réactions d'oxydoréduction.
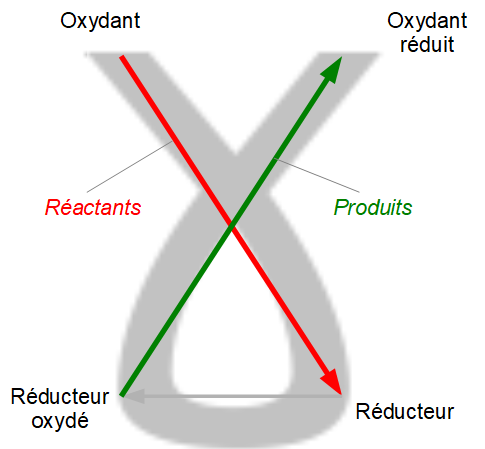 La règle du gamma, ainsi appelée car elle utilise la lettre grecque γ, est donc un outil intuitif permettant de prédire des réactions d'oxydoréduction: si on peut dessiner un gamma entre un oxydant et un réducteur, puis le réducteur oxydé et l'oxydant réduit, alors une réaction peut se produire. C'est la même règle qu'on applique aux couples acide / base pour prédire si deux solutions peuvent se neutraliser.
La règle du gamma, ainsi appelée car elle utilise la lettre grecque γ, est donc un outil intuitif permettant de prédire des réactions d'oxydoréduction: si on peut dessiner un gamma entre un oxydant et un réducteur, puis le réducteur oxydé et l'oxydant réduit, alors une réaction peut se produire. C'est la même règle qu'on applique aux couples acide / base pour prédire si deux solutions peuvent se neutraliser.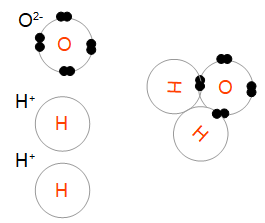 Reste à inférer ce que ces deux ions peuvent faire ensemble : les anions oxygène étant négatifs et les cations hydrogène étant positifs, ils s'attirent et forment des molécules d'eau H2O. Comme il y a assez de chaque pour en former deux, on écrit:
Reste à inférer ce que ces deux ions peuvent faire ensemble : les anions oxygène étant négatifs et les cations hydrogène étant positifs, ils s'attirent et forment des molécules d'eau H2O. Comme il y a assez de chaque pour en former deux, on écrit: