Energie cinétique moyenne dans la matière
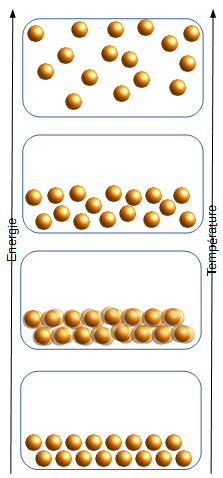
Supposons un ensemble de particules dans un récipient. Sans aucune énergie cinétique, toutes ces particules sont immobiles et attachées les unes aux autres par des liaisons chimiques. On appelle l'état de la matière formée par ces particules solide. Si on donne à ces particules un peu d'énergie, elles vont commencer à bouger mais, attachées les unes aux autres, ce mouvement ne sera qu'une vibration.
Continuons à ajouter de l'énergie. Les vibrations augmentent jusqu'à ce que les liaisons entre les particules se brisent. Les particules sont maintenant libres de bouger les unes par rapport aux autres sans pour autant s'échapper - elles restent au fond du récipient. On appelle l'état de la matière formée par ces particules liquide.
Continuons encore à ajouter de l'énergie. Cette fois, les particules bougent tellement vite qu'elles s'écartent les unes des autres sans plus avoir aucune interaction. Elles bougent chacune librement et occupent tout l'espace du récipient. On appelle l'état de la matière formée par ces particules gaz.
On pourrait continuer à ajouter de l'énergie jusqu'à ce que les atomes composant ce gaz perdent leurs électrons - on aurait alors un plasma. Ce qui est important ici est qu'augmenter l'énergie stockée par chacune des particules dans leur mouvement est directement proportionnel à la température du matériau. En d'autres termes: la température d'un matériau, qu'il soit solide, liquide ou gaz, est une mesure de l'énergie cinétique des particules qui le composent.
Maintenant, tous les matériaux ne stockent pas la même quantité d'énergie; il faut moins d'énergie pour augmenter la température d'un kilogramme d'air d'un degré que pour augmenter la température d'un kilogramme d'eau. Chaque matériau peut donc stocker dans sa température une certaine quantité d'énergie. C'est la capacité thermique massique c.
Par exemple, la capacité thermique de l'air est d'environ 1000 joules par kilogramme kelvin (1000 J kg-1 K-1 ). Cela signifie que dans un kilogramme d'air, on peut stocker 1000 J d'énergie dans chaque degré d'augmentation. En comparaison, la capacité thermique massique de l'eau liquide est de 4185 J kg-1 K-1. On peut donc stocker plus de quatre fois plus d'énergie dans un degré d'un kilogramme d'eau que dans un degré d'un kilogramme d'air.
La chaleur, elle, est l'échange d'énergie entre une zone ou un matériau chaud et une zone ou un matériau froid. Avant d'étudier l'énergie absorbée ou émise par un matériau, nous allons tout d'abord étudier la conduction de chaleur à travers une paroi. Puis, nous utiliserons le concept de capacité thermique massique et d'enthalpie de changement d'état pour étudier les échanges d'énergie entre matériaux.