Energie chimique
Un composé chimique (molécule, composé ionique, cristal…) consiste en une structure composée d'éléments liés entre eux par des liaisons chimiques. Comme raccourci, on dit souvent que l'énergie chimique est stockée dans ces liaisons chimiques - mais c'est un peu plus subtil que ça.
 Pour bien comprendre l'énergie en chimie, on compare souvent la formation d'une molécule à la chute d'une masse attirée par la gravité.
Pour bien comprendre l'énergie en chimie, on compare souvent la formation d'une molécule à la chute d'une masse attirée par la gravité.
On a vu qu'avant qu'elle tombe, une masse a une énergie potentielle gravitique. Lorsqu'elle tombe, cette énergie potentielle est convertie en énergie cinétique, mais ce n'est pas ce qui nous intéresse ici. Une fois que l'objet touche le sol, toute cette énergie est relâchée dans l'environnement: sous forme d'onde sonore, de vibrations dans le sol, de friction avec l'air, etc.
C'est un peu la même chose pour deux éléments qui forment une liaison chimique, mais c'est la force électromagnétique qui attire les deux éléments l'un vers l'autre. Lorsqu'ils "tombent" l'un vers l'autre, ils relâchent de l'énergie sous forme de chaleur et de lumière. Afin de séparer les éléments - briser la liaison chimique - il faudrait les "soulever" (les écarter) et donc ajouter de l'énergie.
Comme l'énergie de formation d'une molécule est relâchée dans l'environnement, elle est négative: l'énergie potentielle est perdue par les éléments. On appelle cette énergie enthalpie standard de formation ΔHf (pour rappel, l'enthalpie est l'énergie contenue par un système, comme par exemple la phase).
Par exemple, l'enthalpie de formation du dioxyde de carbone CO2 est mesurée à partir de la réaction entre du carbone pur (graphite) et du dioxygène O2 (un autre corps pur, puisqu'entièrement composé d'oxygène).
![]()
C + O_2 \rightarrow CO_2 + \Delta H_f
L'enthalpie mesurée dans ce cas (l'énergie relâchée par cette réaction) est de -394 kJ mol-1. Cela signifie que si on laisse réagir une mole de carbone pur avec une mole d'oxygène, on obtiendrait 394 kilojoules d'énergie. Cela signifie aussi que pour détruire une molécule de CO2 et reformer du carbone pur et du dioxygène, il faudrait donner à cette mole de dioxyde de carbone la même énergie.
![]()
CO_2 + \Delta H_f \rightarrow C + O_2
Par définition, il n'y a pas besoin d'énergie pour séparer des corps purs.
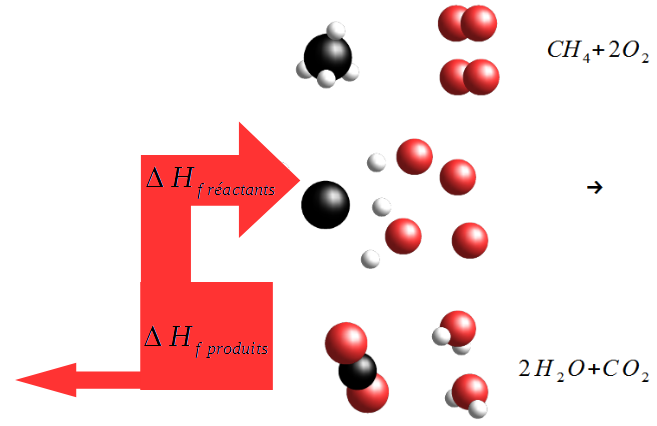 L'enthalpie de réaction ΔrH est simplement le bilan de l'énergie nécessaire pour séparer les éléments d'une ou plusieurs molécules et de l'énergie relâchée par la formation de nouvelles molécules.
L'enthalpie de réaction ΔrH est simplement le bilan de l'énergie nécessaire pour séparer les éléments d'une ou plusieurs molécules et de l'énergie relâchée par la formation de nouvelles molécules.
![]()
\Delta_r H = \sum{ \Delta H_f}_{\text{produits}} - \sum{\Delta H_f}_{\text{reactants}}
Si l'enthalpie de formation des produits est supérieure à celle des réactants (ou réactifs), cela signifie que de l'énergie est donnée à l'environnement. On dit de la réaction qu'elle est exothermique (elle dégage de la chaleur).
Si l'enthalpie de formation des réactants est inférieure à celle des produits, cela signifie que de l'énergie est absorbée - on dit de la réaction qu'elle est endothermique.
Pour comprendre ce calcul dans la pratique, compléter l'exercice suivant.

