Concentration et solubilité
La solubilité est une quantité de soluté que l'on peut dissoudre dans une quantité de solvant. On la donne en grammes par litre ou, parfois, en moles par litres.
Donc, pour savoir si une certaine quantité de matière est soluble, on doit comparer la concentration de la solution de cette matière à sa solubilité.
Par exemple, si on dissout 3 grammes de chlorure de sodium NaCl dans 200 mL d'eau, on peut calculer la concentration massique de la solution:
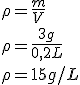
\rho = \frac{m}{V}\\ \rho = \frac{3 g}{0,2 L}\\ \rho = 15 g/L
On sait que la solubilité du chlorure de sodium dans de l'eau à 20°C est 358 g/L. Comme cette valeur est bien supérieure à la concentration que nous venons de calculer, on peut être certain que tout le chlorure de sodium est dissous.
Supposons que nous souhaitions savoir combien de grammes de sel nous pouvons dissoudre dans un volume d'eau avant qu'elle devienne saturée. On sait déjà que la solubilité du chlorure de sodium est de 358 g/L. Cela signifie que si nous avions un litre d'eau, nous pourrions y dissoudre 358 grammes de chlorure de sodium.
Supposons maintenant que nous ayons un verre de 20 cL d'eau et que nous souhaitions y dissoudre le plus de chlorure de sodium possible. Nous recherchons une masse en grammes, nous avons un volume en litres et une solubilité en grammes par litres.
![]()
0,2 L \times \frac{358 g}{ 1 L} = 71,6 g
Supposons enfin que nous ayons 1 kg de sel à dissoudre et que nous cherchions le volume d'eau à utiliser:
![]()
1000 g \times \frac{1 L}{358 g} = 2,8 L
Limite au dessus de laquelle on ne peut plus dissoudre de soluté dans le solvant.
1 L = 100 cL
1 kg = 1000 g