La polarité de l'eau produit un autre phénomène: l'autoprotolyse de l'eau, ou la formation d'ions hydroxydes OH- et d'ions hydroniums H3O+ dans l'eau pure. Il existe alors dans l'eau une égale quantité d'ions positifs et négatifs, rendant la solution entière électriquement neutre.
Un ion hydroxyde OH- est composé d'un oxygène et d'un hydrogène; sa charge est négative.
Un ion hydronium H3O+ est composé d'un atome d'oxygène, de deux atomes d'hydrogène et d'un proton (atome d'hydrogène ayant perdu son électron); sa charge est positive.
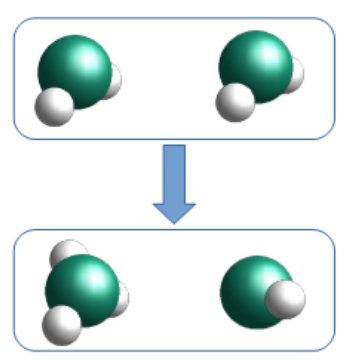
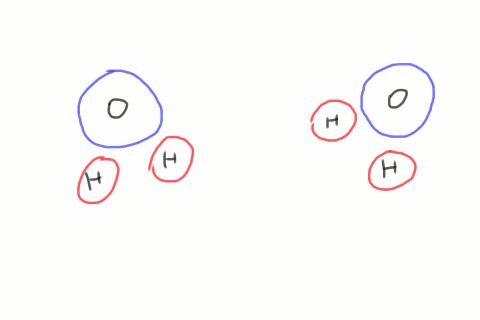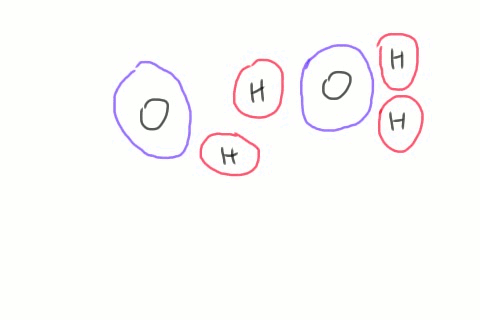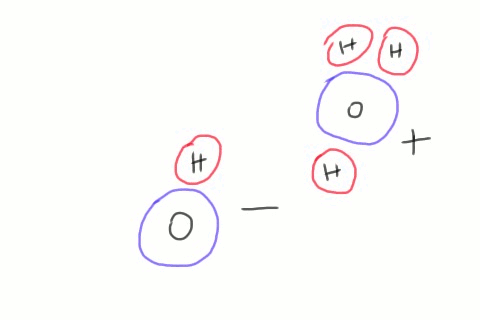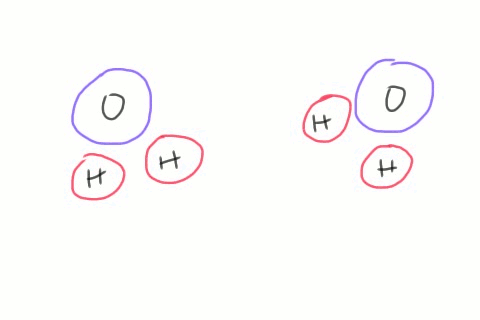 Lorsque deux molécules d'eau se croisent, il arrive que le côté négatif de l'une d'elles arrache un atome d'hydrogène de la seconde. On se retrouve alors avec des quantités égales d'hydroxydes et d'hydroniums. Ces ions n'existent que pour un temps très court, l'hydroxyde récupérant son hydrogène d'une autre molécule de passage, mais le phénomène se produit en permanence dans le récipient d'eau entier. L'équation chimique décrivant ce phénomène contient une flèche double qui indique que la réaction va dans les deux sens.
Lorsque deux molécules d'eau se croisent, il arrive que le côté négatif de l'une d'elles arrache un atome d'hydrogène de la seconde. On se retrouve alors avec des quantités égales d'hydroxydes et d'hydroniums. Ces ions n'existent que pour un temps très court, l'hydroxyde récupérant son hydrogène d'une autre molécule de passage, mais le phénomène se produit en permanence dans le récipient d'eau entier. L'équation chimique décrivant ce phénomène contient une flèche double qui indique que la réaction va dans les deux sens.
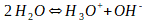
Les concentrations molaires d'hydroxyde et d'hydronium dans l'eau sont donc égales. A des conditions de pression et de température normales (une atmosphère de pression, 25°C), cette concentration est égale 10-7 moles par litre.
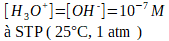
Note: une concentration molaire est symbolisé par la substance entourée de crochets.
On peut créer une quantité dont on sait qu'elle restera constante et qui nous permettra de calculer la concentration en ions hydroxyde ou hydronium: le produit ionique de l'eau Ke. Il s'agit simplement du produit des concentrations de chaque ion dans l'eau pure:
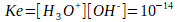
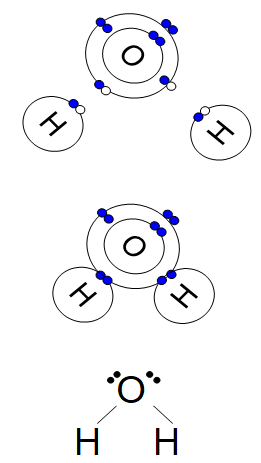
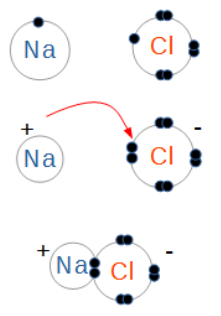
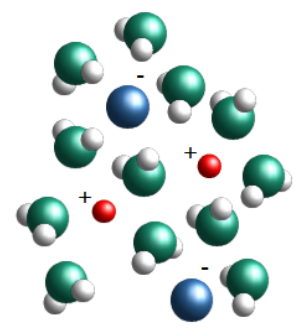

 Lorsque deux molécules d'eau se croisent, il arrive que le côté négatif de l'une d'elles arrache un atome d'hydrogène de la seconde. On se retrouve alors avec des quantités égales d'hydroxydes et d'hydroniums. Ces ions n'existent que pour un temps très court, l'hydroxyde récupérant son hydrogène d'une autre molécule de passage, mais le phénomène se produit en permanence dans le récipient d'eau entier. L'équation chimique décrivant ce phénomène contient une flèche double qui indique que la réaction va dans les deux sens.
Lorsque deux molécules d'eau se croisent, il arrive que le côté négatif de l'une d'elles arrache un atome d'hydrogène de la seconde. On se retrouve alors avec des quantités égales d'hydroxydes et d'hydroniums. Ces ions n'existent que pour un temps très court, l'hydroxyde récupérant son hydrogène d'une autre molécule de passage, mais le phénomène se produit en permanence dans le récipient d'eau entier. L'équation chimique décrivant ce phénomène contient une flèche double qui indique que la réaction va dans les deux sens.