Logarithmes et la définition de l'échelle du pH
Nous avons introduit une quantité précédemment, sans indiquer son utilité: le produit des concentrations d'ions hydronium et hydroxyde - le produit ionique de l'eau.
On a constaté que, en toute logique, augmenter la concentration en un des ions diminue l'autre. Le produit de leurs concentrations reste constant.
Il serait intéressant à ce stade d'utiliser un nouvel opérateur mathématique: le logarithme de base 10.
Le logarithme de base 10 est la puissance à laquelle il faut élever dix pour obtenir un nombre. Par exemple, le logarithme de 100 est 2:
L'utilité d'un logarithme devient évidente lorsqu'on doit représenter un grand nombre:
Les logarithmes de base 10 permettent de représenter et calculer de très grands nombres facilement. Avec l'usage des ordinateurs, leur utilité s'est amoindrie, mais ils restent utiles dans certains domaines - notamment l'échelle du pH.
Les logarithmes peuvent aussi représenter de très petits nombres. Leur logarithme est alors un nombre négatif.
Si on a déjà le logarithme et qu'on cherche le nombre original, il suffit de le mettre à la puissance de dix.
La propriété des logarithmes qui nous intéresse pour le moment est celle-ci:
Si on applique cette propriété au produit ionique de l'eau:
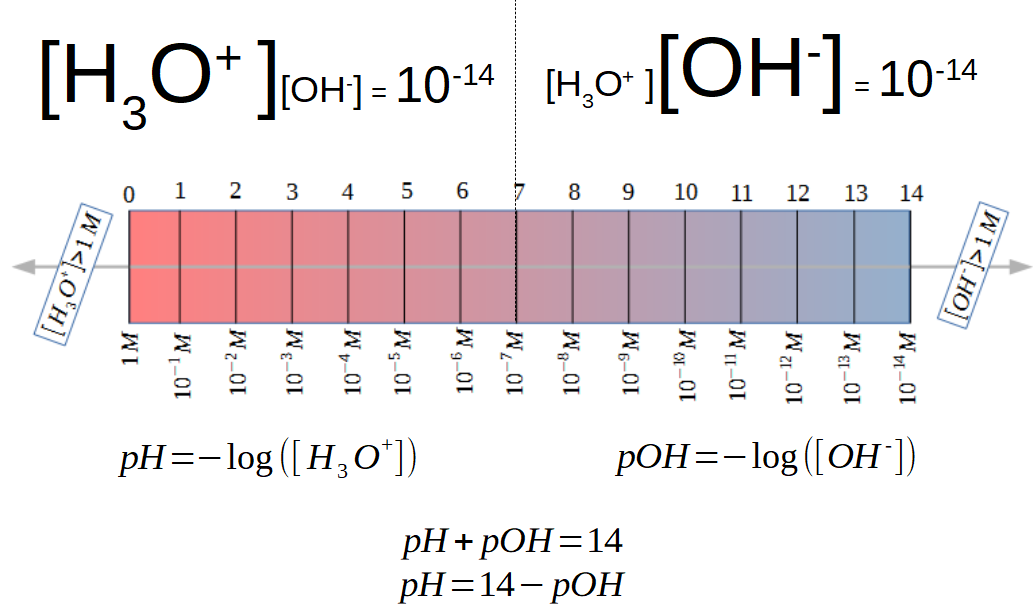
Il nous reste plus alors qu'à définir le pH et sa contrepartie, le pOH:
Le reste est évident: la somme du pH et du pOH d'une solution est toujours égale à 14. De plus, lorsque les concentrations en ions hydroxyde et hydronium sont égales, le pH et le pOH sont tous deux égaux à sept.
Si on n'utilise l'échelle du pOH que rarement, l'échelle du pH est familière. Le papier-pH, par exemple, donne une échelle colorée du pH et donc de la concentration en ions hydroniums d'une solution.
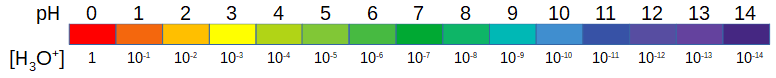
On retiendra que le pH est une mesure de la concentration en ions hydroniums d'une solution. Pour calculer cette concentration à partir du pH, ou pour obtenir le pH à partir d'une concentration en ions hydroniums, il suffit d'y appliquer les règles des logarithmes.