Neutralisation
On sait qu'ajouter un acide à de l'eau augmente sa concentration en ions hydroniums. A l'inverse, ajouter une base augmente celle en ions hydroxyde. Logiquement, si on ajoute un acide et une base, augmenterait-on la concentration des deux?
C'est un plus subtil que ça.
Reprenons les équations de réaction qui décrivent ce qui se passe quand on ajoute un acide d'une part, et qu'on ajoute une base d'autre part. Dans cet exemple, on utilise de l'acide chlorhydrique HCl et de l'hydroxyde de sodium NaOH.
On note que pour la seconde, les H2O s'annulent.
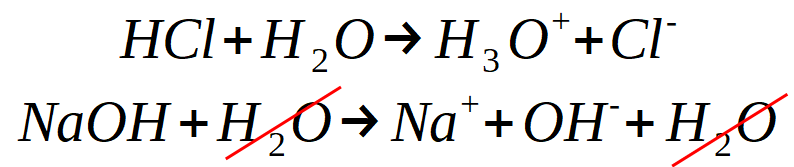
Lorsqu'on mélange un acide et une base, c'est comme si on mélangeait les réactants de ces deux réactions et obtenait leurs produits.
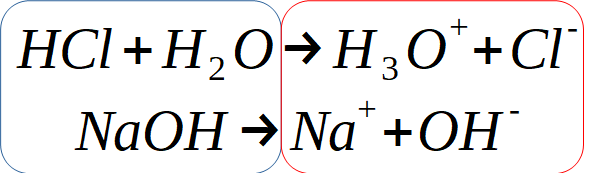
En les combinant, on se rend compte que les ions hydroxyde et hydronium sont regroupés du même côté.
![]()
Ces ions se combinent pour former deux molécules d'eau.
![]()
Comme il y a une molécule d'eau du côté des réactants, elle s'annule avec une des deux qui sont dans les produits.
![]()
A la fin de cette réaction, il ne reste plus d'ions hydronium ou hydroxyde. Ce qui reste est simple: de l'eau et un sel (ici, du NaCl - le chlorure de sodium). Comme il n'y a plus de ce qui causait l'acidité ou la basicité de la solution, on peut deviner qu'elle est neutre. Cette réaction est une neutralisation.
Ainsi, ajouter une base à un acide ou un acide à une base revient à neutraliser la solution - faire en sorte que son pH soit neutre, proche de 7. Il suffit de connaître le pH d'une solution pour savoir quel produit ajouter (acide ou base) et en quelle proportion pour le neutraliser.