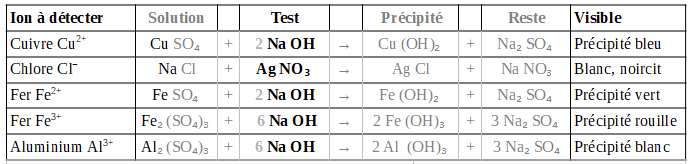
Définition et utilisation de la solubilité
Une expérience sucrée à faire à la maison: rock candy.
Vous avez peut être déjà remarqué qu'il est plus facile de dissoudre du sucre dans de l'eau chaude que dans de l'eau froide. La raison derrière ce phénomène est que la solubilité du sucre dans l'eau - la capacité de l'eau à dissoudre du sucre - dépend de sa température.
On peut mesurer la quantité de sucre qu'on peut complètement dissoudre dans de l'eau à plusieurs températures et reporter cela dans un graphique.
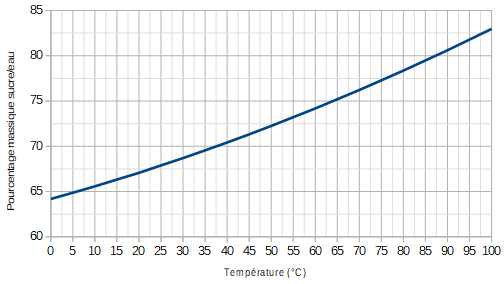
Ainsi, on peut estimer qu'une solution à 100°C peut contenir jusqu'à 83% de sucre (83 grammes de sucre dans 100 grammes d'eau).
Si on fait cette solution et qu'on la laisse refroidir, la solubilité décroît. Cela signifie que moins de sucre peut être dissout dans la solution. A 20°C, uniquement 67 grammes de sucre peuvent être dissous. Qu'arrive-t-il aux 16 grammes restants? Ils se précipitent ou, mieux: ils se cristallisent, c'est à dire qu'ils redeviennent solides. Si on plonge une ficelle qu'on a trempé dans l'eau et dans du sucre en poudre dans le récipient contenant la solution, des petits cristaux réguliers et très durs de sucre se forment: ça fait une sucette originale.
On tire de cette expérience plusieurs termes et idées:
- La solubilité est la capacité d'un solvant à dissoudre une substance (en grammes de soluté par litres de solution g/L)
- La solubilité d'un composé dans un solvant dépend de la température
- Lorsque la concentration d'un composé dépasse sa solubilité, il se précipite